Free Access
| Issue |
Lait
Volume 80, Number 2, March-April 2000
|
|
|---|---|---|
| Page(s) | 223 - 235 | |
| DOI | https://doi.org/10.1051/lait:2000121 | |
DOI: 10.1051/lait:2000121
Characterization of mare caseins.
Identification of
Lait 80 (2000) 223-235
Characterization of mare caseins.
Identification of
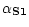 - and
- and
 - caseins
- caseins
Baldorj Ochirkhuyaga - Jean-Marc Chobertb - Michèle Dalgalarrondob - Thomas Haertléb
aInstitute of Chemistry, Academy of Sciences, Ulanbator, Mongolia
bLaboratoire d'étude des interactions des molécules alimentaires, Inra,
BP 71627, 44316 Nantes cedex 03, France
(
Abstract:
Whole mare (Mongolian and French breeds) casein was obtained from skim
milk by isoelectric precipitation (pH 4.6) at 22 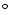 C. In another series of
experiments, equine caseins were fractionated after isoelectric precipitation at 4
C. In another series of
experiments, equine caseins were fractionated after isoelectric precipitation at 4
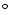 C, according to their sensitivity to temperature, on one hand, the pH of the
resulting pellet was adjusted to 6.5 before centrifugation (45 000 g for 30 min) at
4
C, according to their sensitivity to temperature, on one hand, the pH of the
resulting pellet was adjusted to 6.5 before centrifugation (45 000 g for 30 min) at
4 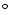 C; on the resulting casein fraction which precipitated was named the cold
precipitated (CP) fraction. On the other hand, the supernatant obtained from the
centrifugation of skim milk at pH 4.6 and 4
C; on the resulting casein fraction which precipitated was named the cold
precipitated (CP) fraction. On the other hand, the supernatant obtained from the
centrifugation of skim milk at pH 4.6 and 4 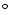 C was warmed to 30
C was warmed to 30 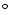 C before being
centrifuged at 30
C before being
centrifuged at 30 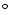 C, 45 000 g, for 30 min. The resulting casein fraction which
precipitated was named the thermally precipitated (TP) fraction. Equine caseins were
then purified by high resolution gel chromatography on an anion-exchange column
followed by reversed phase-high performance liquid chromatography. The casein
fractions were analyzed by urea- and SDS-polyacrylamide gel electrophoresis, their
amino acid compositions were determined and their first 15 N-terminal amino acids
were sequenced. This analysis showed the presence of
C, 45 000 g, for 30 min. The resulting casein fraction which
precipitated was named the thermally precipitated (TP) fraction. Equine caseins were
then purified by high resolution gel chromatography on an anion-exchange column
followed by reversed phase-high performance liquid chromatography. The casein
fractions were analyzed by urea- and SDS-polyacrylamide gel electrophoresis, their
amino acid compositions were determined and their first 15 N-terminal amino acids
were sequenced. This analysis showed the presence of
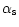 -like caseins isolated from
the CP fraction.
-like caseins isolated from
the CP fraction.
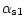 -Like-casein showed 4 major double bands by electrofocusing with
a pI range of 4.3-4.8. In the same conditions,
-Like-casein showed 4 major double bands by electrofocusing with
a pI range of 4.3-4.8. In the same conditions,
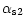 -like casein showed 2 major bands
with a pI range of 4.3-5.1. The TP fraction revealed the existence in equine milk of
6 subfractions of
-like casein showed 2 major bands
with a pI range of 4.3-5.1. The TP fraction revealed the existence in equine milk of
6 subfractions of 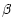 -like caseins, occurring in the following ratios:
1:5:18:20:15:10, differing at least in their degree of phosphorylation (as shown
also by the action of acid phosphatase). Since no evidence of the presence of
-like caseins, occurring in the following ratios:
1:5:18:20:15:10, differing at least in their degree of phosphorylation (as shown
also by the action of acid phosphatase). Since no evidence of the presence of
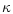 -casein was found in equine milk, it is proposed that part of its functions in the
milk of the Equidae could be assumed by the population of less phosphorylated
-casein was found in equine milk, it is proposed that part of its functions in the
milk of the Equidae could be assumed by the population of less phosphorylated
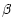 -caseins.
-caseins.
Keywords:
mare milk /
![]() -casein /
-casein /
![]() -casein /
-casein /
![]() -casein
-casein
Résumé:
Caractérisation des caséines du lait de jument. Identification des caséines
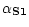 et
et
 .
La caséine entière de lait écrémé de juments issues de troupeaux de
Mongolie et de France a été obtenue par précipitation isoélectrique (pH 4,6) à 22
.
La caséine entière de lait écrémé de juments issues de troupeaux de
Mongolie et de France a été obtenue par précipitation isoélectrique (pH 4,6) à 22  C. Par ailleurs, les caséines équines ont été
fractionnées, après une précipitation isoélectrique à 4
C. Par ailleurs, les caséines équines ont été
fractionnées, après une précipitation isoélectrique à 4  C, selon leur sensibilité à
la température. D'une part, le pH du culot résultant était ajusté à 6,5 avant de
réaliser une nouvelle centrifugation (45 000 g pendant 30 min) à 4
C, selon leur sensibilité à
la température. D'une part, le pH du culot résultant était ajusté à 6,5 avant de
réaliser une nouvelle centrifugation (45 000 g pendant 30 min) à 4 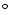 C ; la fraction
caséique qui précipitait était nommée "cold precipitated (CP) fraction''. D'autre
part, le surnageant résultant de la centrifugation du lait écrémé à pH 4,6 et 4
C ; la fraction
caséique qui précipitait était nommée "cold precipitated (CP) fraction''. D'autre
part, le surnageant résultant de la centrifugation du lait écrémé à pH 4,6 et 4 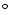 C
était alors réchauffé jusqu'à 30
C
était alors réchauffé jusqu'à 30 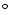 C avant d'être centrifugé à 30
C avant d'être centrifugé à 30 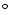 C, 45 000 g,
pendant
30 min. La fraction caséique qui précipitait dans ces conditions était nommée
"thermally precipitated (TP) fraction''. Les caséines équines ont été purifiées
successivement par chromatographie sur colonne d'échange d'anions et chromatographie
liquide haute performance en phase inversée. Les fractions caséiques ont été
analysées par électrophorèse sur gel de polyacrylamide en présence de SDS ou d'urée.
Leur composition en acides aminés et la séquence des 15 premiers résidus N-terminaux
ont été déterminées. Ces analyses et les résultats de l'action de la phosphatase
acide révèlent l'existence dans la fraction TP de 6 fractions de caséine
C, 45 000 g,
pendant
30 min. La fraction caséique qui précipitait dans ces conditions était nommée
"thermally precipitated (TP) fraction''. Les caséines équines ont été purifiées
successivement par chromatographie sur colonne d'échange d'anions et chromatographie
liquide haute performance en phase inversée. Les fractions caséiques ont été
analysées par électrophorèse sur gel de polyacrylamide en présence de SDS ou d'urée.
Leur composition en acides aminés et la séquence des 15 premiers résidus N-terminaux
ont été déterminées. Ces analyses et les résultats de l'action de la phosphatase
acide révèlent l'existence dans la fraction TP de 6 fractions de caséine 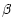 (pI
4,8-5,5), présentes dans les rapports 1:5:18:20:15:10, différant, entre autres, par
leur degré de phosphorylation. Les caséines
(pI
4,8-5,5), présentes dans les rapports 1:5:18:20:15:10, différant, entre autres, par
leur degré de phosphorylation. Les caséines
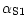 (pI 4,3-4,8) et
(pI 4,3-4,8) et
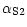 (pI 4,3-5,1) ont été mises en évidence dans la fraction CP. Aucune fraction
caséique assimilable à la caséine
(pI 4,3-5,1) ont été mises en évidence dans la fraction CP. Aucune fraction
caséique assimilable à la caséine 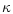 n'a pu être retrouvée ; il est suggéré qu'une
partie des fonctions de la caséine
n'a pu être retrouvée ; il est suggéré qu'une
partie des fonctions de la caséine 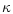 dans le lait des équidés soit assumée par les
populations de caséines
dans le lait des équidés soit assumée par les
populations de caséines 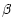 les moins phosphorylées.
les moins phosphorylées.
Mots clé :
lait de jument / caséine
![]() / caséine
/ caséine
![]() / caséine
/ caséine ![]()
Correspondance et tirés à part : Jean-Marc Chobert
Tel.: (33) 2 40 67 50 85; fax: (33) 2 40 67 50 84; chobert@nantes.inra.fr
Copyright INRA, EDP Sciences


