Free Access
| Issue |
Lait
Volume 80, Number 5, September-October 2000
|
|
|---|---|---|
| Page(s) | 517 - 526 | |
| DOI | https://doi.org/10.1051/lait:2000142 | |
DOI: 10.1051/lait:2000142
Plasmin digestion of bovine
Lait 80 (2000) 517-526
Plasmin digestion of bovine 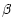 -casein dephosphorylated with one
protein phosphatase type 2A purified from Yarrowia lipolytica
-casein dephosphorylated with one
protein phosphatase type 2A purified from Yarrowia lipolytica
Pascale Joliveta - Isabel Queiroz Macedob - Min Wua - Jean-Claude Meuniera
aLaboratoire de Chimie Biologique, INRA, INA PG, Centre de
Biotechnologies Agro-Industrielles, 78850 Thiverval-Grignon, France
bChemistry Department, University of Aveiro, 3810 Aveiro, Portugal
(
Abstract:
Bovine 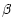 -casein was dephosphorylated by the catalytic sub-unit of a type 2A protein
phosphatase (PP2Ac) purified from the yeast Yarrowia lipolytica. Complete
dephosphorylation was obtained after 24 to 30 h in Tris buffer (pH 7.5). On
the contrary, the activity of PP2Ac was largely inhibited (80%) in the presence
of 13 mmol
-casein was dephosphorylated by the catalytic sub-unit of a type 2A protein
phosphatase (PP2Ac) purified from the yeast Yarrowia lipolytica. Complete
dephosphorylation was obtained after 24 to 30 h in Tris buffer (pH 7.5). On
the contrary, the activity of PP2Ac was largely inhibited (80%) in the presence
of 13 mmol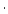 L-1 sodium citrate (pH 6.8). After dephosphorylation of
L-1 sodium citrate (pH 6.8). After dephosphorylation of 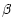 -casein,
plasminolysis was increased and more 3% TCA-soluble peptides were obtained
(30% increase). Dephosphorylation led to the disappearance of the f 29-105/107
peptide and to the appearance of a new non-phosphorylated 8 200 g
-casein,
plasminolysis was increased and more 3% TCA-soluble peptides were obtained
(30% increase). Dephosphorylation led to the disappearance of the f 29-105/107
peptide and to the appearance of a new non-phosphorylated 8 200 g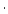 mol-1 peptide,
suggested to be f 33-105/107 originated from the middle part of the
mol-1 peptide,
suggested to be f 33-105/107 originated from the middle part of the 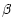 -casein
sequence and obtained upon plasmin cleavage of the Lys32-Phe33 peptide bond.
-casein
sequence and obtained upon plasmin cleavage of the Lys32-Phe33 peptide bond.
Keywords:
![]() -casein / dephosphorylation / protein phosphatase / Yarrowia lipolytica / plasmin
-casein / dephosphorylation / protein phosphatase / Yarrowia lipolytica / plasmin
Résumé:
Hydrolyse par la plasmine de la caséine 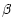 bovine déphosphorylée par une protéine
phosphatase de type 2A purifiée chez Yarrowia lipolytica. La caséine
bovine déphosphorylée par une protéine
phosphatase de type 2A purifiée chez Yarrowia lipolytica. La caséine 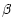 peut être
déphosphorylée par la sous-unité catalytique d'une protéine phosphatase de type 2A
purifiée chez la levure Yarrowia lipolytica. La déphosphorylation complète est obtenue
en 24 à 30 h en tampon Tris (pH 7.5).
À l'inverse, elle est largement inhibée par le citrate
de sodium 13 mmol
peut être
déphosphorylée par la sous-unité catalytique d'une protéine phosphatase de type 2A
purifiée chez la levure Yarrowia lipolytica. La déphosphorylation complète est obtenue
en 24 à 30 h en tampon Tris (pH 7.5).
À l'inverse, elle est largement inhibée par le citrate
de sodium 13 mmol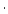 L-1 à pH 6.8 (80 % d'inhibition). Après déphosphorylation, la
plasminolyse de la caséine
L-1 à pH 6.8 (80 % d'inhibition). Après déphosphorylation, la
plasminolyse de la caséine 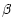 est augmentée puisque l'on observe une production
supplémentaire de 30 % de peptides solubles dans le TCA à 3 %. La déphosphorylation se
traduit par la disparition du peptide f 29-105/107 et l'apparition d'un nouveau peptide
non phosphorylé de 8 200 g
est augmentée puisque l'on observe une production
supplémentaire de 30 % de peptides solubles dans le TCA à 3 %. La déphosphorylation se
traduit par la disparition du peptide f 29-105/107 et l'apparition d'un nouveau peptide
non phosphorylé de 8 200 g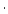 mol-1. Il pourrait s'agir du peptide f 33-105/107 provenant
de la partie centrale de la séquence protéique de la caséine
mol-1. Il pourrait s'agir du peptide f 33-105/107 provenant
de la partie centrale de la séquence protéique de la caséine 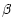 et obtenu par attaque de
la liaison peptidique Lys32-Phe33.
et obtenu par attaque de
la liaison peptidique Lys32-Phe33.
Mots clé :
caséine b / déphosphorylation / protéine phosphatase /
Yarrowia lipolytica / plasmine
Correspondence and reprints: Pascale Jolivet
tel. (33) 1 30 81 54 67; fax: (33) 1 30 81 53 73;
e-mail: jolivet@grignon.inra.fr
Copyright INRA, EDP Sciences


