Free Access
| Issue |
Lait
Volume 80, Number 5, September-October 2000
|
|
|---|---|---|
| Page(s) | 491 - 501 | |
| DOI | https://doi.org/10.1051/lait:2000140 | |
DOI: 10.1051/lait:2000140
Lait 80 (2000) 491-501
Purification and characterization of an intracellular esterase from Propionibacterium freudenreichii ssp. freudenreichii ITG 14
Evangellia Kakariari - Marina D. Georgalaki - George Kalantzopoulos - Effie Tsakalidou
Laboratory of Dairy Research, Department of Food Science and Technology,
Agricultural University of Athens, Iera Odos 75, 118 55 Athens, Greece
(
Abstract:
An intracellular esterase from Propionibacterium freudenreichii ssp. freudenreichii ITG 14
was purified by anion exchange and gel filtration chromatography. The enzyme
had a molecular weight of 47 400 g mol-1 as determined by gel filtration chromatography,
with an optimum activity on
mol-1 as determined by gel filtration chromatography,
with an optimum activity on  -naphthyl-acetate at pH 6.0 and at 65
-naphthyl-acetate at pH 6.0 and at 65 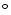 C,
with
C,
with 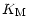 = 1.2 mmol
= 1.2 mmol L-1. The esterase hydrolyzed synthetic substrates of low molecular
weight (C2-C4), and among triglycerides only triacetin. Sulfhydryl group reagents and
metal chelators had limited or no effect on enzyme activity; highest inhibition was
observed with phenylmethyl sulfonyl fluoride (PMSF).
L-1. The esterase hydrolyzed synthetic substrates of low molecular
weight (C2-C4), and among triglycerides only triacetin. Sulfhydryl group reagents and
metal chelators had limited or no effect on enzyme activity; highest inhibition was
observed with phenylmethyl sulfonyl fluoride (PMSF).
Keywords:
Propionibacterium freudenreichii ssp. freudenreichii / esterase /
purification / characterization
Résumé:
Purification et caractérisation d'une estérase intracellulaire de Propionibacterium
freudenreichii ssp. freudenreichii ITG 14. Une estérase intracellulaire extraite de
Propionibacterium freudenreichii ssp. freudenreichii ITG 14 a été purifiée par
chromatographie échangeuse d'anions et chromatographie d'exclusion de taille.
L'enzyme avait une masse moléculaire de 47 400 g mol-1, comme déterminé par
chromatographie d'exclusion de taille, et elle avait une activité maximale sur le
substrat
mol-1, comme déterminé par
chromatographie d'exclusion de taille, et elle avait une activité maximale sur le
substrat  -naphthyl-acétate à pH 6,0 et 65
-naphthyl-acétate à pH 6,0 et 65 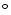 C, avec
C, avec 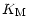 = 1,2 mmol
= 1,2 mmol L-1.
L'estérase dégradait des substrats synthétiques de faible poids moléculaire (C2-C4), et
parmi les triglycérides seulement la triacétine. Des groupements sulfydryles et des
chélateurs de métaux n'avaient aucun effet ou un effet limité sur l'activité
enzymatique ; la plus forte inhibition a été observée lors de l'utilisation du PMSF.
L-1.
L'estérase dégradait des substrats synthétiques de faible poids moléculaire (C2-C4), et
parmi les triglycérides seulement la triacétine. Des groupements sulfydryles et des
chélateurs de métaux n'avaient aucun effet ou un effet limité sur l'activité
enzymatique ; la plus forte inhibition a été observée lors de l'utilisation du PMSF.
Mots clé :
Propionibacterium freudenreichii ssp. freudenreichii / estérase /
purification / caractérisation
Correspondence and reprints: Effie Tsakalidou
tel. (30) 1 529 4676; fax: (30) 1 529 4672;
e-mail: et@aua.gr
Copyright INRA, EDP Sciences


