| Issue |
Lait
Volume 76, Number 6, 1996
|
|
|---|---|---|
| Page(s) | 523 - 535 | |
| DOI | https://doi.org/10.1051/lait:1996641 | |
DOI: 10.1051/lait:1996641
The gene encoding 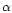 s1-casein is expressed in human mammary epithelial cells during lactation
s1-casein is expressed in human mammary epithelial cells during lactation
P. Martina, G. Brignonb, J.P. Fureta and C. Lerouxa a Laboratoire de génétique biochimique et de cytogénétique
b Laboratoire de recherches laitières, Inra, 78352 Jouy-en-Josas cedex, France
Received 31 July 1996; accepted 11 September 1996
Abstract - Reverse-phase high performance liquid chromatograhy followed by N-terminal microsequencing performed directly on each peak collected has provided a comprehensive survey of six individual human milk protein fractions. Sequencing of tryptic peptides arising from a putative ![]() s1-casein fraction identifies sequences showing some similarity with
s1-casein fraction identifies sequences showing some similarity with ![]() s1 -casein from other species. Ordering of these tryptic peptides and finally deciphering of the human
s1 -casein from other species. Ordering of these tryptic peptides and finally deciphering of the human ![]() s1-casein amino acid sequence was achieved after cloning and sequencing of the relevant cDNA, amplified by reverse transcription-polymerase chain reaction starting from mRNA extracted from mammary epithelial cells harvested from breast milk. Shorter than its ruminant counterparts (170 vs 199 amino acid residues) the human
s1-casein amino acid sequence was achieved after cloning and sequencing of the relevant cDNA, amplified by reverse transcription-polymerase chain reaction starting from mRNA extracted from mammary epithelial cells harvested from breast milk. Shorter than its ruminant counterparts (170 vs 199 amino acid residues) the human ![]() s1-casein displays very low similarities with
s1-casein displays very low similarities with ![]() s1-caseins known so far, very likely owing to combinatory splicing processes, characteristic for each species, as well as to genomic rearrangements. It is else-where distinguishable by the presence of three cysteinyl residues. Multiple forms of
s1-caseins known so far, very likely owing to combinatory splicing processes, characteristic for each species, as well as to genomic rearrangements. It is else-where distinguishable by the presence of three cysteinyl residues. Multiple forms of ![]() s1-casein messengers were identified from each individual mRNA sample studied, strongly suggesting, therefore, a differential splicing from a single primary transcript. Finally, we provide definite evidence for the existence of a functional
s1-casein messengers were identified from each individual mRNA sample studied, strongly suggesting, therefore, a differential splicing from a single primary transcript. Finally, we provide definite evidence for the existence of a functional ![]() s1-Cas locus in the human genome, which is expressed in the mammary tissue during lactation.
s1-Cas locus in the human genome, which is expressed in the mammary tissue during lactation.
Résumé - Le gène spécifiant la caséine ![]() s1 est exprimé dans les cellules épithéliales mammaires humaines pendant la lactation
s1 est exprimé dans les cellules épithéliales mammaires humaines pendant la lactation
Les techniques de chromatographie liquide haute pression en phase inverse (RP-HPLC) et de microséquençage directement effectué sur chaque pic collecté ont permis d'établir un inventaire détaillé de la fraction protéique de six laits humains individuels. Le séquençage des peptides trypsiques provenant d'une fraction supposée contenir la caséine ![]() s1 a fourni des séquences présentant un certain degré de similarité avec les caséines
s1 a fourni des séquences présentant un certain degré de similarité avec les caséines ![]() s1 d'autres espèces. L'agencement de ces peptides trypsiques, et finalement le décryptage de la structure primaire de la caséine
s1 d'autres espèces. L'agencement de ces peptides trypsiques, et finalement le décryptage de la structure primaire de la caséine ![]() s1 humaine, a été obtenu après clonage et séquençage de l'ADNc correspondant, amplifié par RT-PCR à partir d'ARN messagers extraits de cellules épithéliales mammaires isolées du lait humain par centrifugation. Plus courte que ses homologues décrites chez les ruminants (170 résidus d'acides aminés contre 199), la caséine
s1 humaine, a été obtenu après clonage et séquençage de l'ADNc correspondant, amplifié par RT-PCR à partir d'ARN messagers extraits de cellules épithéliales mammaires isolées du lait humain par centrifugation. Plus courte que ses homologues décrites chez les ruminants (170 résidus d'acides aminés contre 199), la caséine ![]() s1 humaine présente un faible degré de similarité avec les caséines
s1 humaine présente un faible degré de similarité avec les caséines ![]() s1 connues à ce jour, très probablement en raison de processus d'épissage combinatoire, caractéristiques de chaque espèce, mais aussi en raison de remaniements survenus au niveau génomique. Elle se distingue par ailleurs par la présence de trois résidus cystéinyle. Des formes multiples de transcrits spécifiant la caséine
s1 connues à ce jour, très probablement en raison de processus d'épissage combinatoire, caractéristiques de chaque espèce, mais aussi en raison de remaniements survenus au niveau génomique. Elle se distingue par ailleurs par la présence de trois résidus cystéinyle. Des formes multiples de transcrits spécifiant la caséine ![]() s1 ont été identifiées à partir de chaque échantillon d'ARNm individuel étudié, suggérant ainsi fortement la mise enjeu d'un épissage différentiel affectant un seul type de transcrit primaire. Finalement, nous apportons la preuve définitive de l'existence d'un locus
s1 ont été identifiées à partir de chaque échantillon d'ARNm individuel étudié, suggérant ainsi fortement la mise enjeu d'un épissage différentiel affectant un seul type de transcrit primaire. Finalement, nous apportons la preuve définitive de l'existence d'un locus ![]() s1-Cas fonctionnel dans le génome humain, s'exprimant dans le tissu mammaire, pendant la lactation.
s1-Cas fonctionnel dans le génome humain, s'exprimant dans le tissu mammaire, pendant la lactation.
Key words: breast milk / RP-HPLC / human
Mots clés : lait humain / RP-HPLC / caséine
© INRA, EDP Sciences 1996


